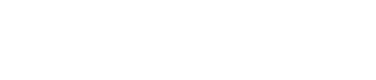近年來🙅♂️,視黃酸受體相關孤兒受體RORγt的腫瘤免疫學調節功能受到廣泛關註🤦🏿,RORγt也成為極具潛力的腫瘤免疫治療新興靶標。研究表明,腫瘤微環境中高表達的輔助性T細胞17(Th17細胞)和其分泌的細胞因子白介素17(IL-17)🧚🏽♀️,能通過激活腫瘤特異性CD8+ T細胞(Tc17細胞)來抑製腫瘤增殖。RORγt在Th17和Tc17細胞中特異性表達🌋,是調節CD4+ T細胞向Th17細胞分化🦈、細胞毒性Tc17細胞產生及促炎因子IL-17A分泌的關鍵轉錄因子。RORγt激動劑能夠促進Th17細胞分化及IL-17A的產生,激活Tc17細胞的殺傷力🟥,從而發揮免疫抗腫瘤作用👩🏭。因此🏋🏻,開發新型RORγt激動劑對於小分子腫瘤免疫治療具有重要意義⚀🎲。
MK体育平台藥學院王永輝教授研究團隊致力於新型RORγt小分子調節劑的發現及其作用機製研究,報道了多種不同骨架類型的RORγt調節劑🤷🏻♂️,包括用於自身免疫性疾病治療的RORγt抑製劑(反向激動劑)和用於癌症免疫治療的RORγt激動劑😠;並在RORγt受體抑製-激動功能反轉的分子機製方面深入探索,先後於2018年和2021年分別在藥物化學領域權威期刊《藥物化學雜誌》(Journal of Medicinal Chemistry)上發表兩篇綜述(Miniperspective, J. Med. Chem. 2018, 61, 5794−5804; Perspective, J. Med. Chem.2021, 64, 10519–10536)🦵🏽🍄。
近日,謝瓊副教授和王永輝教授團隊在藥物化學權威期刊《藥物化學雜誌》(Journal of Medicinal Chemistry)上發表一篇新的研究性論文《高效👼🏼、選擇性和口服有效的聯芳基酰胺類RORγt激動劑的發現及其癌症免疫治療應用》(Discovery of Biaryl Amide Derivatives as Potent, Selective, and Orally Bioavailable RORγt Agonists for Cancer Immunotherapy)。該論文發現了一類具有成藥潛力的聯芳基酰胺類RORγt小分子激動劑,其不僅在體外表現出優異的RORγt受體激動活性及亞型選擇性🤹🏼♀️,而且在體內表現出良好的藥代動力學性質,在小鼠黑色素瘤和小鼠肺腺癌兩類模型中展現出良好的單藥體內抗腫瘤效果,具有潛在的開發和應用前景。
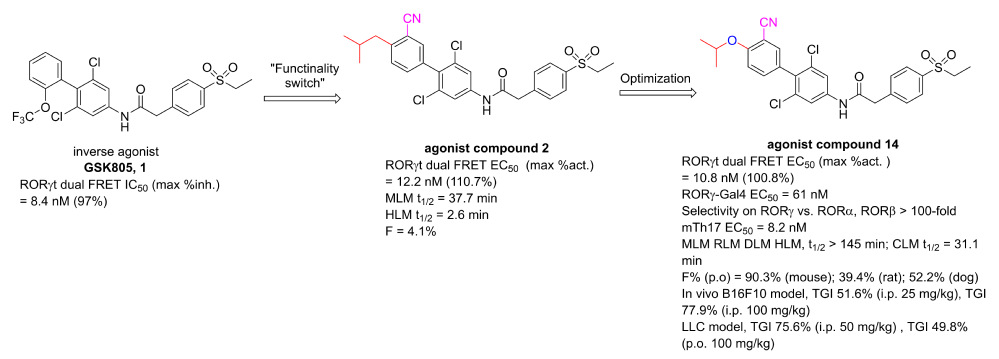
圖1. 新型聯芳基酰胺類RORγt激動劑的發現和成藥性優化
本研究以RORγt反向激動劑GSK805(1)為起點,利用“功能翻轉”策略在左側苯環引入不同大小的對位取代基🍡👩🏻🍳,得到異丁基取代的RORγt激動劑2🧑🦯➡️。該化合物體外活性優異(EC50 = 12.2 nM)🔑,但肝微粒體穩定性(HLM: t1/2 = 2.6 min)和口服生物利用度(mice,F = 4.1%)較差🚵♂️。采用生物電子等排等策略對聯芳基酰胺類化合物的左側片段、連接鏈和右側片段進行微調,以求在維持激動功能的前提下優化成藥性,發現了優於臨床II期化合物LYC-55716的潛在RORγt激動劑候選化合物14(圖1)。異丙氧基取代的化合物14具有較強的RORγt激動效力(RORγt dual FRET: EC50 = 10.8 nM; mTh17: EC50 = 8.2 nM),較高的RORγ受體亞型選擇性(>100倍),優異的多種屬肝微粒體代謝穩定性(mouse, dog, rat and human LM: t1/2 > 145 min),以及優良的口服生物利用度(F = 90.3 % (mouse), 39.4% (rat), 52.2% (dog))。
體內藥效評價和作用機製研究與MK体育平台朱棣教授團隊合作,化合物14表現出優異的體內抗腫瘤活性(圖2),在小鼠B16F10黑色素瘤和LLC肺腺癌腫瘤模型中腫瘤生長抑製率(TGI)分別達到77.9%(100 mg/kg, i.p., 圖2A)和75.6%(50 mg/kg, i.p., 圖2B)🧑🏼🚒,且顯著增加化合物14治療組(25 mg/kg, i.p.)LLC腫瘤內CD3+ T細胞和CD4+ T細胞中IL-17A+細胞的比例(圖2C-D),以及Rorc和Il-17a基因的表達水平(圖2E-F)👜。化合物14的心臟hERG毒性低,mini-AMES試驗顯示無致突變作用,顯示出作為新型RORγt激動劑候選藥物在癌症免疫治療方面的巨大潛力。
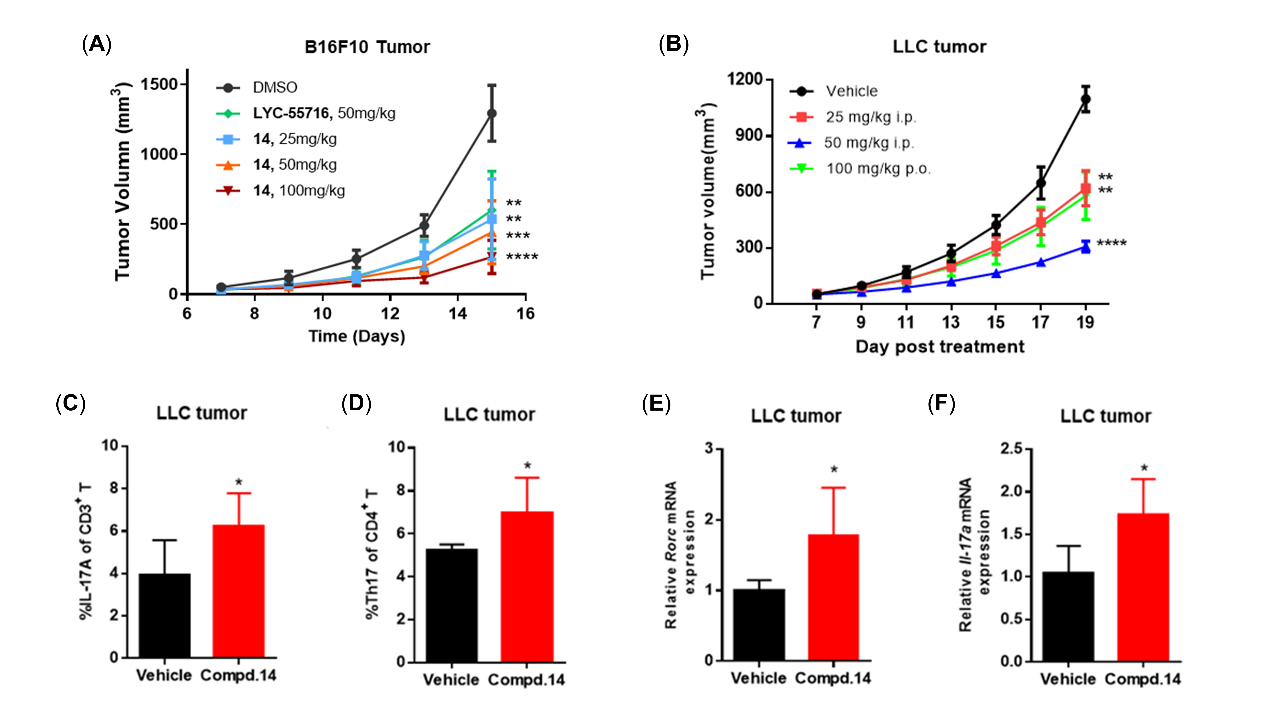
圖2. 候選化合物14在小鼠B16F10(A)和LLC(B)腫瘤模型中的體內藥效,以及化合物14治療後LLC瘤內CD3+ T細胞(C)和CD4+ T細胞(D)中IL-17A+細胞比例及Rorc(E)和Il-17a(F)基因表達水平的變化
分子對接研究發現,化合物14的碸基與RORγt配體結合域(LBD)中的Leu287和Arg367形成關鍵的氫鍵作用,酰胺linker中的NH與Phe377的羰基形成氫鍵❎,結構中的三個苯環分別與Phe377、Phe378和Phe388形成π-π堆積作用(圖3A)🎀。為理解激動劑化合物14的異丙氧基如何通過穩定RORγt 活性功能域2(AF2)而將功能翻轉為激動作用,該團隊與MK体育平台藥學院李嫣副研究員團隊合作完成動力學模擬研究。研究結果顯示,苯環對位無取代的反向激動劑2b因與蛋白之間存在較大的空腔,Tyr502容易發生構象翻轉而迫使His479-Tyr502氫鍵斷裂(圖3C),而激動劑化合物14的異丙氧基可以穩定蛋白結構中His479和 Tyr502之間的氫鍵(圖3B),這一氫鍵對於穩定AF2螺旋12(H12)的激動構象和維持RORγt受體激動功能至關重要。
圖3. 化合物14-RORγt LBD對接模式圖(A)、激動劑14(B)和反向激動劑2b(C)在RORγt LBD中的分子動力學模擬結果(蛋白H11-H12起始構象顯示為白色,運行至1000ns的構象分別顯示為藍綠色和粉色)
MK体育平台藥學院藥物化學系博士生魯麗雪、博士黃亞飛和科研助理宋美旗為本論文的共同第一作者👮♀️;MK体育平台藥學院謝瓊副教授和王永輝教授為本論文的共同通訊作者。相關化合物已獲得中國(CN108863850B)🖐🏿、美國(US10844017B)和日本(JP6953538B2)專利授權💛💠。
原文鏈接:https://doi.org/10.1021/acs.jmedchem.3c01492
王永輝教授🤹、謝瓊副教授課題組介紹
MK体育平台藥學院藥物化學系王永輝教授、謝瓊副教授課題組主要研究方向是自身免疫病與腫瘤免疫治療小分子藥物的發現,以及有機與藥物化學新方法新技術的研究▪️。現有講座教授1名,副教授1名,在讀博士研究生3名🦹🏿♀️、碩士研究生4名,已畢業博士7名🧑🏼⚕️、碩士5名🧚🏽♀️。課題組先後承擔國家科技重大專項、國家自然科學基金面上項目、上海市科委生物醫藥領域科技支撐項目、上海市自然科學基金等科研項目20余項,累計經費超過1100萬元。近5年在J Med Chem, Eur J Med Chem, J Org Chem, ACS Med Chem Lett等學術期刊發表通訊作者SCI論文25篇🧑🚒;申請中國專利16項(已獲6項授權),2項國際PCT專利申請進入美國、日本😬、歐洲(已獲6項國際專利授權)。在自身免疫病和腫瘤免疫治療小分子藥物研究中,發現多個具有開發潛力的候選藥物👨🚀,正在進行臨床前評價。