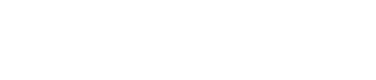2023年8月7日,溫文玉課題組在PNAS雜誌上發表了題為 “ Feedback regulation of ubiquitination and phase separation of HECT E3 ligases ”的研究工作。該研究揭示了HECT型泛素連接酶通過液液相分離(LLPS)促進其長鏈泛素化活性的新機製☝️,拓展了對HECT型E3活性調控的認知🧗🏼🙅🏽♂️,也為HECT型E3酶活性失調相關疾病的幹預提供了新的思路。

泛素化是一種受到高度調控的蛋白質翻譯後修飾,泛素激活酶E1-結合酶E2-連接酶E3的有序酶促反應催化單泛素分子或泛素鏈共價連接到底物蛋白,進而參與信號傳導🧑🏽🚀、蛋白酶體降解、細胞自噬🧎♂️➡️、以及DNA損傷修復等一系列細胞活動。E3介導將泛素由E2轉移到底物的最後一步🫲🏿,因而決定了泛素化修飾的特異性🏊🏼♂️。Nedd4家族 (Itch, Smurf1/2, WWP1/2, Nedd4/4L和NEDL1/2) 是人源HECT型E3最大的一個亞類,具有相似的結構組成:用於亞細胞定位的C2結構域📏、2-4個結合底物的WW結構域以及催化結構域HECT。靜息狀態下🧑🏻🦽,Nedd4家族成員保持較低的酶活性從而避免非特異的泛素化修飾💂👰♀️。
MK体育平台生物醫學研究院溫文玉課題組近年來對Nedd4家族E3的活性調控機製開展了系統研究,闡明了Itch及其果蠅同源蛋白Su(dx)👨🏽💻、以及WWP1的自抑製機製🧻,提出了Nedd4家族活性的多鎖調控模型。同期,約翰霍普金斯大學的Philip A. Cole課題組解析了WWP2的自抑製結構,其與Itch的自抑製結構高度相似,他們發現Linker的磷酸化可以破壞其與HECT的結合從而釋放HECT,強調了基於Linker的激活機理。這幾項工作提示多位點抑酶機製可以使Nedd4 E3在結合不同激活因子/底物或經過翻譯後修飾展現出不同的活性🍹,從而更精確地調控其酶活性,使其在特定時空間行使功能。然而♑️,這些基於晶體結構的靜態信息無法解釋高效酶促反應中的開關狀行為。
不同於前期對Nedd4家族酶活反應的研究,作者意外發現當Itch與含有一個PPAY 基序的接頭蛋白Spartin共表達時形成細胞內凝聚體🧑🏻🦲,體外重組酶活系統觀察到Itch在催化反應後形成高度動態的液滴結構,這是液液相分離的典型特點。Itch凝聚體的形成強烈依賴於泛素化反應的發生,並且在凝聚體內富集泛素𓀘、Itch、激活蛋白Spartin以及E2等泛素化反應元件。通過體外泛素化實驗對Itch酶活性和相分離現象的觀察➿,作者發現Itch的泛素化反應可以分為兩個階段:(1)起始短鏈泛素合成階段(Ub<4),幾乎無長鏈泛素生成,也沒有相分離現象🏚;(2)Ub4及以上的長鏈泛素化產物呈開關狀迅速產生🚵🏽♂️,同時發生相分離現象。Itch的相分離和長鏈泛素化活性展示出完美的同步性🕖,提示相分離依賴於長鏈泛素的產生👨🦽➡️🧻。
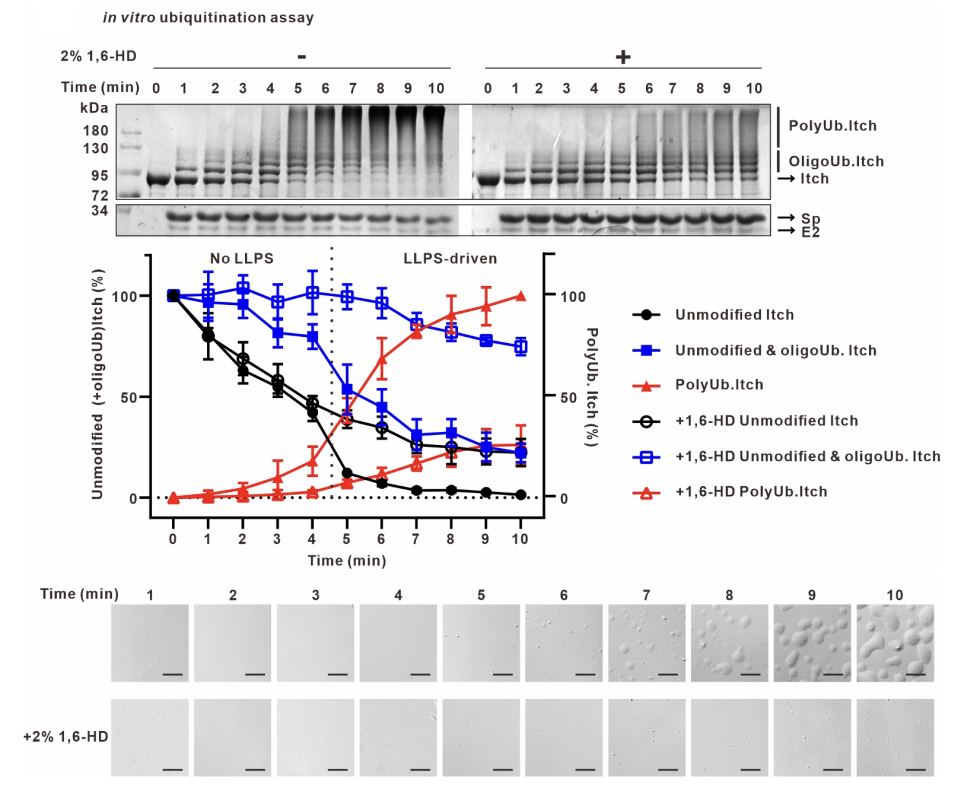
由於Itch催化的長鏈泛素生成不是勻速過程🫰🏽,而是前期慢後期快,且相分離凝聚了泛素化反應成分,作者推測相分離可以提高泛素化效率。此外,作者還證明了Itch相分離和長鏈泛素化活性之間相互依賴相互促進的正反饋關系。
長鏈泛素是多種細胞活動的重要信號。該研究發現Itch的相分離由保守的HECT結構域和長鏈泛素之間的多價疏水相互作用驅動,Spartin並不直接參與相分離,而是通過結合Itch的WW釋放HECT以激活Itch合成泛素鏈。該研究還發現破壞Itch的相分離降低了Itch-Spartin對脂滴周轉的調節能力,提出定位於脂滴表面的Itch-Spartin活性凝聚體在調節脂滴周轉中發揮功能。
MK体育平台溫文玉研究員為本論文通訊作者🧑🏿🍼,博士生李靜宇和祝康博士(現為牛津大學病理系博士後)為並列第一作者🤟🏿,博士生顧愛紅、黃仕敬和碩士生張怡晴也參與了部分工作🏃♂️。
原文鏈接: https://www.pnas.org/doi/10.1073/pnas.2302478120