先天性心臟病是新生兒最常見的出生缺陷,發病率高達0.4%~1%,也是嬰幼兒死亡的主要原因之一📉。心臟發育受到很多基因的逐級精密調控,這些基因的突變與先天性心臟病的發生密切相關🧑🏽🎨。
轉錄因子MESP1在發育早期瞬時表達,調控心臟前體細胞(cardiac progenitor)等的產生,但其激活早期心臟發育基因的機製仍待研究。已有報道在先天性心臟病病人中👩🏽🦳,發現了MESP1多個位點的單等位基因突變(single-allele mutation),表觀遺傳因子PRC1(Polycomb repressive complex 1)復合體、黏連蛋白(cohesin)復合體的多個組分也報道存在先天性心臟病致病突變,而這些組分在心臟發育中的具體作用機製還不清楚。
2022年11月21日🤦,MK体育平台基礎醫學院孫寧實驗室和MK体育平台生物醫學研究院(IBS)藍斐實驗室在Developmental Cell(《發育細胞》)在線發表論文Essential role of MESP1-RING1A complex in cardiac differentiation,發現轉錄因子MESP1結合表觀因子RING1A在心臟發育中共同發揮重要作用🚵🏻♀️。

本研究首次發現MESP1可與PRC1核心蛋白RING1A相互作用,協同結合並激活人類心臟早期發育相關基因表達🚴🏿,如中胚層形成相關基因WNT5A、NCAM1、LEF1🌥、ZEB2、MEIS1🫳、MEIS2👨🏼🦲、PDGFRA🥿👍🏼、GATA6,與心臟譜系基因MYOCD和MEF2C;並發現RING1A在人類心肌細胞體外分化和小鼠心臟發育過程中發揮重要作用:RING1A缺失會導致人類心肌體外分化效率、收縮蛋白表達、鈣處理能力等的下降;Ring1A敲除小鼠此前只報道過中軸骨發育異常,本研究發現Ring1A敲除小鼠出現與MESP1突變病人類似的先天性心臟病表型👨🏼🏫,如主動脈騎跨🥀、室間隔缺損、肺動脈狹窄👮🏻♂️、致密化心室壁變薄等。
PRC1復合體的經典作用是抑製基因表達;近年來也有報道在皮膚、神經發育等過程中,PRC1可參與基因表達的激活。本研究發現MESP1-RING1A可與cohesin復合體🗞、p300結合,通過調控A/B區室(compartment A/B)轉換、增強子-啟動子的染色質相互作用(chromatin interaction)、組蛋白乙酰化,激活心臟發育相關基因的表達。
本研究同時發現,MESP1致病突變會影響MESP1與RING1A、cohesin組分的結合➡️,影響心臟發育基因的表達及心肌的正常分化👨🏽✈️。
總之,這些研究不僅證明了MESP1-RING1A在心臟發育中的重要性,同時也為MESP1🈚️,PRC1 和 cohesin組分突變導致先天性心臟病的機製提供了可能的解釋。
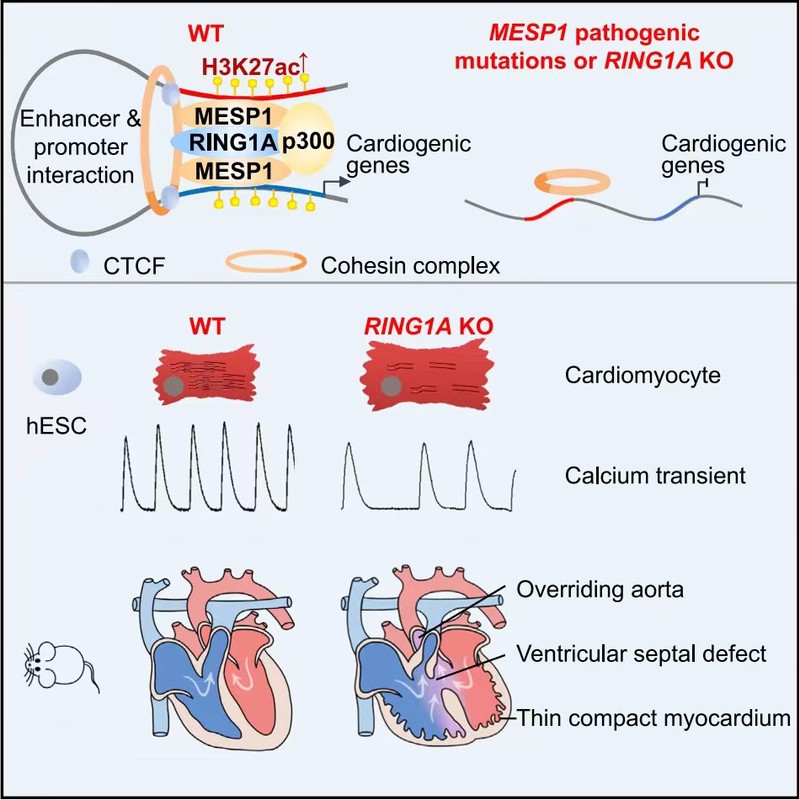
轉錄因子MESP1與表觀遺傳因子RING1A協同調控早期心臟發育
孫寧教授和藍斐研究員為論文共同通訊作者。MK体育平台基礎醫學院梁倩倩青年副研究員、生物醫學研究院王司清博士和基礎醫學院博士生周心妍為共同第一作者。研究還得到了廣東省人民醫院的朱平教授🪮、紀念斯隆-凱特琳癌症中心的徐一馳博士等合作者的大力支持。
原文鏈接:https://www.cell.com/developmental-cell/fulltext/S1534-5807(22)00761-4