2022年9月1日,MK体育平台放射醫學研究所邵春林教授團隊在Nature旗下British Journal of Cancer上在線發表題為“Exosomal protein angiopoietin-like 4 mediated radioresistance of lung cancer by inhibiting ferroptosis under hypoxic microenvironment”的研究論文,發現乏氧肺癌細胞外泌體可抑製周圍富氧肺癌細胞的鐵死亡👼🏼,從而誘導其產生輻射抵抗效應👨🏼💼📰,並揭示了外泌體ANGPTL4蛋白是其中的關鍵信號分子。該研究為肺癌的分子靶向治療與放療的聯合運用提供了的新的探索途徑。

肺癌是對人群生命健康以及社會負擔影響最大的惡性腫瘤🛒,已成為全球癌症死因的第一位🧏🏽♀️,放療作為肺癌治療的主要手段已經取得實質性的進展,但放療抵抗仍是部分患者放療後預後不良與復發的主要原因🐪。乏氧是腫瘤微環境中最為顯著的特征,長期以來一直被認為是導致實體腫瘤輻射抵抗最為關鍵的因素☎。近年來,作為腫瘤微環境中的主要組成部分🤺🆖,外泌體在腫瘤發生發展中的作用引起了越來越多的關註🤦🏽♂️;特別是在乏氧腫瘤微環境中,腫瘤來源的外泌體能夠向腫瘤細胞和基質細胞傳遞特異的生物信號,在介導腫瘤細胞之間🏃♂️、腫瘤與正常組織之間的信息交流中發揮重要作用🧑🏻✈️。因此,探究引起肺癌放療抵抗的調控基因及相關機製,降低肺癌放療抗性,對改善肺癌放療療效與預後至關重要。
近日🐙👳🏿♀️,放射醫學研究所研究生張育紅等人通過一系列實驗證明,乏氧能顯著促進肺癌細胞中ANGPTL4蛋白的表達並在外泌體中富集,其表達水平與肺癌細胞的輻射抵抗呈正相關,而乏氧外泌體可運載ANGPTL4蛋白至常氧腫瘤旁細胞🚵♀️,引起其輻射抵抗🧏🏽♂️。進一步研究發現,乏氧可促進肺癌細胞中鐵死亡抑製性調節蛋白GPX4、SLC7A11等的表達,減少脂質過氧化作用並抑製鐵死亡,進而介導肺癌的輻射抵抗效應⏫;而過表達或敲低ANGPTL4的表達,可分別抑製或激活鐵死亡信號通路🙄。同時,載有較高水平ANGPTL4蛋白的乏氧外泌體可顯著促進周圍常氧腫瘤細胞內ANGPTL4的表達⛸,抑製鐵死亡信號通路📥。
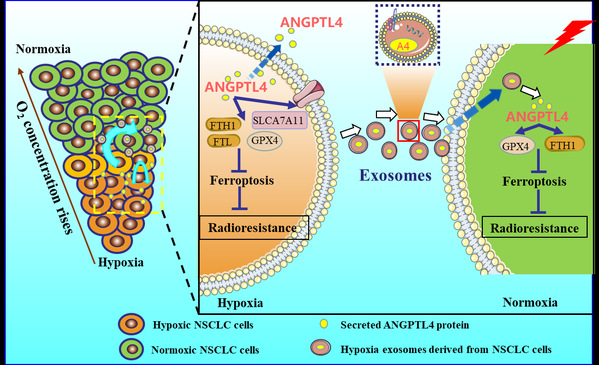
圖:乏氧微環境中 ANGPTL4 通過抑製肺癌細胞鐵死亡促進輻射抵抗的機製圖
這些研究表明,乏氧誘導的ANGPTL4蛋白至少通過兩條平行的途徑促進肺癌的輻射抵抗作用🥵。首先,乏氧可促進肺癌細胞ANGPTL4蛋白表達和分泌,抑製鐵死亡通路、介導輻射抵抗。此外,分泌型ANGPTL4蛋白能夠裝載於乏氧腫瘤細胞衍生的外泌體中🧔🏻♂️,穩定地傳遞給周圍常氧區的腫瘤細胞,以乏氧外泌體-ANGPTL4-GPX4依賴性機製,抑製常氧區腫瘤細胞的鐵死亡通路,誘導這些細胞對輻射產生抵抗,進而將乏氧區腫瘤細胞的輻射抵抗效應傳遞給常氧區腫瘤細胞。該研究所揭示的細胞內ANGPTL4蛋白和乏氧外泌體ANGPTL4蛋白在乏氧腫瘤微環境中誘導輻射抵抗的作用機製♔,因此👮🏿♂️,靶向ANGPTL4可能是一種改善肺癌放療療效的新治療策略。
MK体育平台放射醫學研究所研究生張育紅為論文的第一作者✋🏿,張江虹副研究員是該文的首要通訊作者🐣,邵春林研究員是共同通訊作者。該研究獲得了國家自然科學基金、上海市科委科研計劃重點項目的資助👨👧。