2022年8月23日,MK体育平台放射醫學研究所邵春林教授團隊在 Cell Death and Differentiation 上在線發表題為“SOCS2-enhanced ubiquitination of SLC7A11 promotes ferroptosis and radiosensitization in hepatocellular carcinoma”的研究論文,揭示細胞因子信號抑製因子2(suppressor of cytokine signaling 2, SOCS2)是肝癌潛在的輻射增敏靶點,過表達SOCS2可促進鐵死亡關鍵蛋白SLC7A11發生K48鏈型泛素化降解🛏,調控鐵死亡的發生。該研究為肝癌個體化放療方案的製定提供了新思路。

肝細胞癌(Hepatocellular carcinoma, HCC)是發病率居高的腹部惡性腫瘤之一,是全球腫瘤相關死亡的第四大原因。晚期肝癌患者通常表現出對化療的高度耐藥性和根治性手術的低成功率,而HCC細胞對放射線的敏感性適中🦈🎺,因此進展期HCC患者通常采用放療來降低腫瘤的侵襲🙏🏼,但部分HCC細胞因其先天性輻射抵抗或放療過程中誘導的獲得性輻射抵抗而限製放療療效。因此,了解介導HCC輻射抵抗的潛在靶點或分子機製📵,將可轉化應用於臨床肝癌患者的放療療效的提高,改善患者預後。
近日,放醫所博士研究生陳倩萍等人通過60Gy光子輻照構建HCC輻射耐受株,結合基因組學、TCGA數據庫及包含11組肝癌隊列的HCCDB數據庫的差異基因分析👩🏿⚖️,發現SOCS2為肝癌潛在的輻射增敏基因。實驗發現⬜️,輻射耐受的HCC細胞、HCC移植瘤或臨床腫瘤組織具有更低水平的鐵死亡🧆,以RSL3激活HCC細胞發生鐵死亡可增強HCC細胞的輻射敏感性。分子機製研究表明,SOCS2作為一種E3泛素連接酶,可特異性地誘導SLC7A11蛋白的泛素化與降解,從而促進HCC的輻射增敏。HCC細胞受輻照後🤾♀️,SOCS2表達增加🆖,一方面它通過其L162和C166殘基與胞內的Elongin B/C復合體相互作用,共同形成E3泛素連接酶以招募泛素分子;另一方面,SOCS2利用其SH2結構域與SLC7A11的NTD結構域結合,並作為橋梁分子將泛素分子轉移至SLC7A11蛋白👨🏻🦵🏿,誘導K48鏈連接的SLC7A11蛋白多聚泛素化降解。該研究詮釋了SOCS2蛋白、鐵死亡及其輻射耐受三者之間關系,證實SOCS2蛋白通過促進鐵死亡介導肝癌的輻射增敏,因此♈️,靶向SOCS2可能是一種改善HCC放療療效的治療策略。
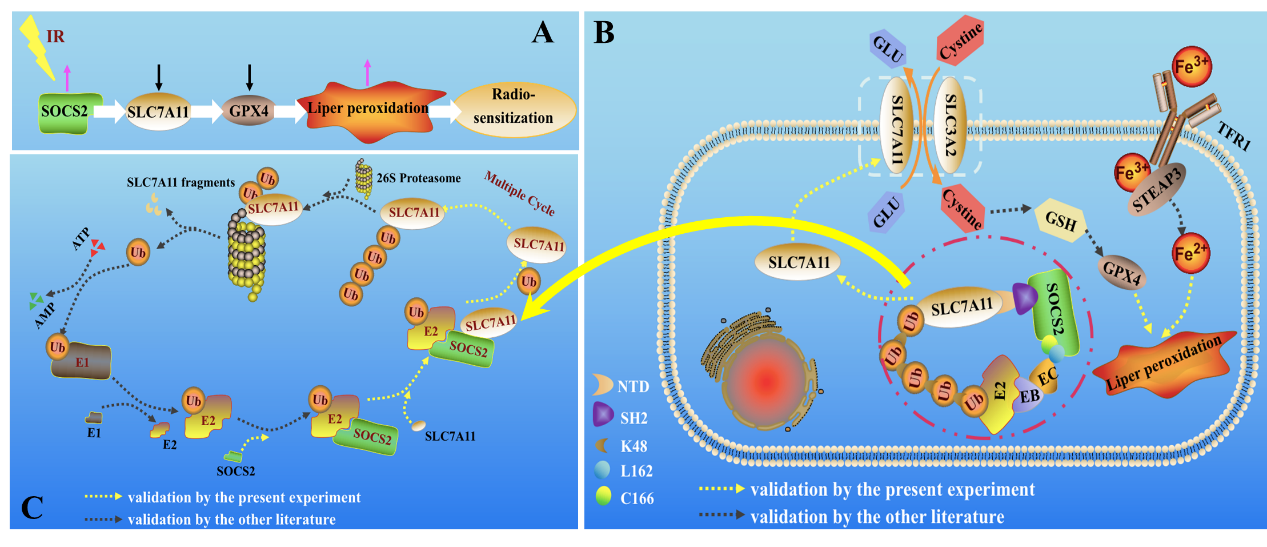
SOCS2促進SLC7A11的泛素化降解、誘導肝癌細胞鐵死亡與放射增敏
MK体育平台放射醫學研究所博士研究生陳倩萍和鄭旺為論文的共同第一作者🚄📵,邵春林教授為該論文的首要通訊作者,副研究員張江虹和潘燕為共同通訊作者🤞🏻🦎。