作為一種治療腫瘤的新方法,免疫治療近年來飛速發展𓀌🙅🏿♂️,已經應用於多種腫瘤的臨床治療✷,並取得良好效果。然而,對於有“最毒乳腺癌”之稱的三陰性乳腺癌♖,以靶向PD-1/ PD-L1為首的免疫治療卻依然存在受益人群有限、缺少療效預測指標等局限性🤵🏿♀️,這也成為全球醫學界亟需破解的難題之一👩🏻🏫。
6月30日🧖🏼,從MK体育平台附屬腫瘤醫院傳來消息🏊🏼,該院乳腺外科主任兼MK体育平台腫瘤研究所所長邵誌敏教授、精準腫瘤中心胡欣研究員、乳腺外科狄根紅教授領銜的團隊,通過構建“免疫醫生”文庫♞,結合團隊三陰性乳腺癌多組學研究,首次成功鎖定基因“半乳糖結合凝集素2”是三陰性乳腺癌介導免疫逃逸的“幫兇”🫳🏻,並且有望成為三陰性乳腺癌免疫治療新靶點,為三陰性乳腺癌的免疫治療提供了新的方向✡︎🌸。該項成果同日於國際權威期刊《科學·進展》(Science Advances)在線發表🕰,影響因子14.95分。

“免疫醫生”篩選“最毒乳腺癌”免疫逃逸“幫兇”
人的身體裏每天都有腫瘤細胞產生🌧,但與生俱來的免疫系統會形成一種防禦和保護機製🛄,這個系統就像體內的警察一樣,能識別對身體不利的細胞,隨時進行摧毀和清除。如果免疫功能異常,機體就不能識別惡性細胞,則容易形成腫瘤。
能否有效篩選並甄別腫瘤免疫基因,為腫瘤精準治療奠定基礎?為此,MK体育平台附屬腫瘤醫院研究團隊以三陰性乳腺癌為切入點⏮,對2796個疾病相關免疫基因進行CRISPR/Cas9基因編輯,構建了“Dr. Immune”(免疫醫生)文庫🙇🏻♂️。通過將導入文庫的三陰性乳腺癌細胞分別種植到免疫力完整和免疫力重度缺陷的小鼠中🤽♀️,監測和分析腫瘤生長過程中富集或丟失的細胞👰🏼♀️。批量性觀察在“腫瘤-免疫”的交互狀態下,這些基因在小鼠體內究竟是參與免疫監視,還是免疫逃逸💍👩❤️💋👨。
基於第一輪“免疫醫生”的篩選,研究團隊進一步升級🤟🏿,定製開發出更為精細的“mini-Dr. Immune”(迷你免疫醫生)🦹🏼♀️,放到設計更精妙的多維免疫狀態下開展二輪篩選。通過一輪輪篩選的抽絲剝繭,發現同一基因在不同免疫狀態下▶️,對抗腫瘤的協同/拮抗作用可能是不同的🚶🏻♂️,有的甚至截然相反。這個發現很好演繹了同樣的免疫治療在部分患者身上有效,但在部分患者身上無效的情況,這一情況很可能與患者本身的免疫狀態有關(圖一)👵🏽。
在三陰性乳腺癌中是否是有關鍵分子♠︎,總是能“幫助”腫瘤細胞偽裝🔃,逃避免疫系統中各路免疫細胞的追殺呢👈🏼?根據“免疫醫生”的篩選結果👨👧👦,並基於復旦腫瘤乳腺團隊邵誌敏教授、江一舟教授等已開展的三陰性乳腺癌多組學研究,研究團隊成功鎖定半乳糖結合凝集素2(Lectin galactose-binding soluble 2, LGALS2)為三陰性乳腺癌介導免疫逃逸的關鍵分子。
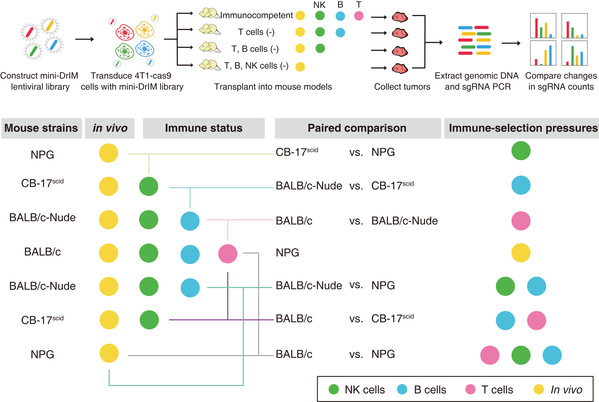
圖一:“Dr. Immune”(免疫醫生)篩選模式圖
關鍵分子LGALS2打破三陰性乳腺癌免疫治療“瓶頸”
通過進一步的表型研究和機製探究,研究團隊借助動物模型、單細胞測序技術🫄🏿、RNA測序技術🥵🔳、細胞共培養技術等💧💆🏻♀️,研究人員發現關鍵分子LGALS2主要通過調控集落刺激因子1及其受體軸(CSF1/CSF1R)💍,招募更多的腫瘤相關巨噬細胞浸潤到腫瘤微環境中,同時促進這些腫瘤相關巨噬細胞向具有抗炎及促腫瘤作用的M2型方向極化,從而增加了腫瘤微環境中的免疫抑製現象。因此,靶向LGALS2的治療有望成為三陰性乳腺癌新的免疫治療策略(圖二)👩🏽🎓。
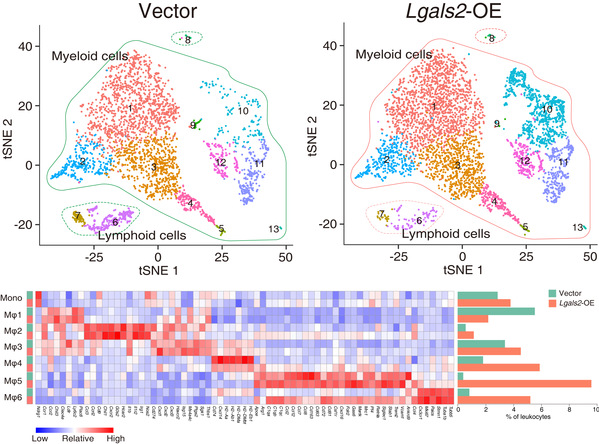
圖二🔑:LGALS2通過招募腫瘤相關巨噬細胞🧜,並促進其向M2方向極化,促進免疫逃逸
隨後,研究團隊進一步開展動物體內實驗,發現無論是靶向LGALS2所調控的CSF1/CSF1R軸的藥物🧛🏼♀️,還是直接靶向LGALS2的中和性抗體藥,都取得了顯著的療效👨🚀🚶♀️➡️,腫瘤的生長受到明顯抑製🤴,三陰性乳腺癌免疫微環境中的免疫抑製現象顯著逆轉🐀。這些結果均提示👨🏽🔧,LGALS2作為三陰性乳腺癌潛在的免疫治療新靶點,有望突破目前三陰性乳腺癌免疫治療的瓶頸,打開免疫治療的新局面,為三陰性乳腺癌患者延長生存提供嶄新的機會和可能🤸🏻♂️。